Noonan综合征(Noonan syndrome,努南综合征)
Noonan综合征(Noonan syndrome,努南综合征)
【概述】
Noonan综合征(Noonan syndrome,努南综合征)1963年由Noonan和Ehmke首次认定为一种疾病,他们发现一系列的病人伴有特殊面容和多发畸形,包括先天性心脏病。这些病人以前被认为是Turner综合征的一种,因为Turner综合征和Noonan综合征有很多相似的临床特征。Noonan综合征和Turner综合征的重要鉴别点在于Noonan综合征的核型正常。
Noonan综合征的主要特征包括:特殊面容(即眼距增宽、睑裂下斜、蹼颈)、先天性心脏病、身材矮小和胸部畸形。大约25%的患者有精神发育迟滞,一半的患者有出血倾向。骨骼系统、神经系统、泌尿生殖系统、淋巴系统、眼睛和皮肤可不同程度地受累。
【病理生理学】
Noonan综合征的病理生理机制还不是很明确,但是其与RAS/RAF/MEK/ERK信号转导通路上的部分基因突变相关,RAS/RAF/MEK/ERK信号转导通路为细胞生长的重要调控因素。大约50%的患者有PTPN11的突变,另外10%-13%和5-17%的患者有SOS1和RAF1、RIT1的突变。KRAS、NRAS、BRAF和MAP2K1上的突变也有被发现,但是患者数量比较少。
【流行病学】
发生频率 美国:Noonan综合征的发病率大约为1000-2500个活婴中有一个。
全球:Noonan综合征的发病率在世界范围内似乎是一致的。
死亡率/发病率 Noonan综合征患者的发病和死亡主要依赖于先天性心脏病的出现及类型。
Noonan综合征能使一些特定肿瘤的风险轻度增加。Noonan综合征中最常见的肿瘤为神经母细胞瘤、急性淋巴细胞白血病、低级别的胶质瘤和横纹肌肉瘤。与Noonan综合征一样,所有这些肿瘤都与RAS信号通路的突变相关。幼年粒单核细胞白血病和骨髓增殖性疾病也与Noonan综合征相关。
不同基因型的Noonan综合征患者生长模式不同。在出生的时候,PTPN11突变的患者比SOS1、KRAS或Noonan综合征伴多发雀斑样痣相关PTPN11(NSML-PTPN11)的患者要矮和瘦。到2岁的时候,PTPN11突变的患者与SOS1或NSML-PTPN11患者相比,生长迟滞更加严重和频繁。到了10岁的时候,虽然Noonan综合征患者的体重指数普遍来说比较低,但是不同的基因型之间生长没有差别。
种族 Noonan综合征为泛族裔疾病。
性别 Noonan综合征为散发或常染色体显性遗传,其发病无男女性别差异。
年龄 出生即起病,但是年龄能影响面部表型。婴儿期单靠面部表现很难识别Noonan综合征。到童年早期,面部表现很明显,但随着年龄增长,面部表现会再次变得很隐匿。对受累患者的父母仔细检查可能能发现他们轻度受累。
【临床表现】
病史 Noonan综合征的产前病史通常是不显著的,然而,一些案例表现为羊水过多、胎儿水肿、颈项透明层增厚、囊性水瘤或先天性心脏病(特别是肺动脉瓣发育不良)。
需要仔细询问家族史,特别需要注意受累患者的父母或同胞先天性心脏病、精神发育迟滞、身材矮小、面容异常的出现。
一个轻度面部异常的患儿可能仅仅表现为发育延迟和先天性心脏病的病史。异常出血史可出现于50%的患者。
尿便失禁影响很大一部分的Noonan综合征的儿童,这种表现一般不持续到成年期。
【查体】
生长指数:大约80%的患者会出现身材矮小,男性成人平均身高为5英尺5英寸,女性成人平均身高为5英尺。
面部特征:
包括以下部分:三角脸、眼距增宽、睑裂下斜、上睑下垂、斜视(48%)、弱视(33%)、屈光不正(61%)、低位耳伴耳轮增厚、鼻梁高、短的蹼颈
部分患者有Noonan样/多发巨细胞病变综合征(NS/MGCLS),以通常出现在下颌的良性、肿瘤样病变为特征。这一情况以前被认为独立于Noonan综合征,但是现在认为是Noonan综合征的一种。NS/MGCLS与PTPN11和SOS1基因突变相关。
眼睛特征:眼距增宽、眼睑异常、弱视、近视、散光、斜视、眼球运动受限、角膜神经突出、立体视觉异常和后部角膜弓。
听觉特征:进行性高频感音神经性耳聋的发生率高达50%。
胸/背特征:鸡胸和/或漏斗胸、脊柱侧凸。
心血管系统:心脏缺陷可出现于80%的患者。特征性的表现为肺动脉瓣发育不良/狭窄,但事实上Noonan综合征患者可出现各种先天性心脏缺陷。肥厚性心肌病(梗阻型或非梗阻型)可见于30%的患者,可在出生时、婴儿期或儿童期出现。其他频繁出现的心脏缺陷包括房间隔和室间隔缺损、肺动脉分支狭窄、Fallot四联征和主动脉缩窄。
腹部特征:与心脏状态无关的肝脾肿大见于25%的患者。
泌尿生殖系统:肾脏异常见于10%的患者,但一般临床上不重要。多于一半的男性患者有睾丸未降。
骨骼系统:一半的患者有关节松弛。马蹄内翻足、桡尺骨融合、颈椎融合和关节挛缩不常见。
皮肤:包含以下部分:①淋巴水肿
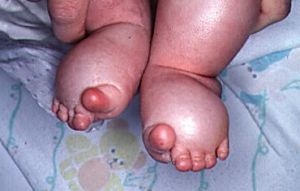 婴儿足部淋巴水肿,脚趾显示为香肠样外观
婴儿足部淋巴水肿,脚趾显示为香肠样外观
婴儿足部淋巴水肿,脚趾显示为香肠样外观
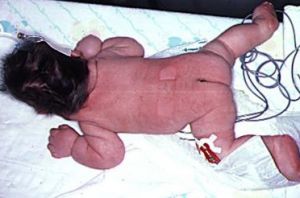 婴儿全身淋巴水肿,颈部周围松弛的皮肤皱褶在之后可形成
婴儿全身淋巴水肿,颈部周围松弛的皮肤皱褶在之后可形成婴儿全身淋巴水肿,颈部周围松弛的皮肤皱褶在之后可形成
②手指和脚趾有突出的指垫(67%)③面部和伸侧皮肤毛囊角化(14%)④多发雀斑样痣(3%)。
神经系统 包括以下部分:①肌张力低。②癫痫。③无法解释的周围神经病(不常见)。
【病因】
包括散发和常染色体显性遗传案例。女性患者青春期发育和生育能力正常,男性生育能力因睾丸未降而降低。因此在家系案例中母亲为更常见的传递亲本。
Noonan综合征的致病基因、所占患者比例及可用的检测方法见下表:
| 基因 | 患者比例 | 检测方法能检测到致病突变的比例 | |
| 测序分析 | 靶向基因的缺失/重复分析 | ||
| PTPN11 | 50% | 接近100% | 重复罕见,对NS的诊断存在疑问 |
| SOS1 | 10-13% | 100% | 未知 |
| RAF1 | 5% | 接近100% | 一个被报导的案例存在重复,对NS的诊断存疑
一个被报导的案例为缺失 |
| RIT1 | 5% | 100% | 未知 |
| KRAS | <5% | 100% | 未知 |
| NRAS | 8个患者和4个家系 | 100% | 未知 |
| BRAF | <2% | 100% | 未知 |
| MAP2K1 | <2% | 100% | 未知 |
| 其他 | 未知 | ||
SOS1突变的患者一般来说认知功能比PTPN11突变的患者要好。SOS1突变的患者身高一般正常,RAF1突变的患者与肥厚性心肌病和发育迟缓相关。
Noonan综合征的OMIM条目如下:
| 163950 | NOONAN SYNDROME 1; NS1 |
| 164757 | V-RAF MURINE SARCOMA VIRAL ONCOGENE HOMOLOG B1; BRAF |
| 164760 | V-RAF-1 MURINE LEUKEMIA VIRAL ONCOGENE HOMOLOG 1; RAF1 |
| 164790 | NEUROBLASTOMA RAS VIRAL ONCOGENE HOMOLOG; NRAS |
| 176872 | MITOGEN-ACTIVATED PROTEIN KINASE KINASE 1; MAP2K1 |
| 176876 | PROTEIN-TYROSINE PHOSPHATASE, NONRECEPTOR-TYPE, 11; PTPN11 |
| 182530 | SON OF SEVENLESS, DROSOPHILA, HOMOLOG 1; SOS1 |
| 190070 | V-KI-RAS2 KIRSTEN RAT SARCOMA VIRAL ONCOGENE HOMOLOG; KRAS |
| 609591 | RIC-LIKE PROTEIN WITHOUT CAAX MOTIF 1; RIT1 |
| 609942 | NOONAN SYNDROME 3; NS3 |
| 610733 | NOONAN SYNDROME 4; NS4 |
| 611553 | NOONAN SYNDROME 5; NS5 |
| 613224 | NOONAN SYNDROME 6; NS6 |
| 613706 | NOONAN SYNDROME 7; NS7 |
| 615355 | NOONAN SYNDROME 8; NS8 |
Noonan综合征的一些热点突变
| 基因 | DNA核苷酸改变 | 预测的蛋白改变 | 参考序列 |
| BRAF | c.722C>T | p.Thr241Met |
NM_004333.4 |
| c.722C>G | p.Thr241Arg | ||
| c.1593G>C | p.Trp531Cys | ||
| c.1789C>G | p.Leu597Val | ||
| NRAS | c.71T>A | p.Ile24Asn | NM_002524.4 |
| c.101C>T | p.Pro34Leu | ||
| c.149C>T | p.Thr50Ile | ||
| c.179G>A | p.Gly60Glu | ||
| PTPN11 | c.922A>G | p.Asn308Asp | NM_002834.3 NP_002825.3 |
| c.179_181delGTG | p.Gly60del | ||
| c.181_183delGAT | p.Asp61del |
【外显率】
因为确认偏倚和表现度的差异以及很多患者的表现很隐匿Noonan综合征的外显率很难确定。许多受累的成人在生出一个表现很明显的婴儿后才得到诊断。
【鉴别诊断】
心面皮肤综合征(CFC综合征):与Noonan综合征的表现存在很大程度的重叠。CFC综合征与NS有相似的心脏和淋巴系统表现。CFC综合征的智力障碍通常更严重,更可能出现中枢神经系统结构性异常。皮肤病理更加鲜艳,胃肠道表现更加严重且持续时间长,出血倾向罕见。面部常见表现包含面容粗陋、长头畸形和眉毛缺失,蓝眼睛少见,目前已知的导致CFC综合征的四个基因包括BRAF (约75%)、MAP2K1、MAP2K2(约25%)和KRAS (<2%-3%)。
Costello综合征:与Noonan综合征和心面皮肤综合征都存在相似之处。许多患者进行了分子遗传学的检测,没有发现PTPN11的致病性突变。胚系致病性变异最常发生于HRAS原癌基因的2号外显子。
Turner综合征:只在女性中出现,细胞遗传学检测能发现性染色体异常,当考虑到面部、心脏、发育和肾脏的时候,Turner综合征的表型与NS非常不同。Turner综合征肾脏异常更常见,发育迟缓少见,左心缺陷更常见。
Watson综合征:以身材矮小、肺动脉瓣狭窄、不同程度的智力发育水平和皮肤色素改变(咖啡牛奶斑)为特征。Watson综合征的表型与神经纤维瘤病1型的表型存在重叠,被认为是同一等位基因病。
Noonan综合征样疾病伴或不伴JMML:CBL的胚系突变能够导致多变的表型,包括相对高发的神经系统异常、幼年粒单核细胞白血病易感和心脏缺陷、生长迟缓和隐睾的低发生率。
神经纤维瘤病1型:与NS共享一些表现,包括身材矮小、学习困难和牛奶咖啡斑。少数病人也有NS综合征病人类似的面部表现。这可能是由于NS和NF1同时出现。然而,大多数时候是因为携带NF1致病突变的患者表现出NS样的面部表现。
【初诊后的评估】
初诊后需要对以下情况进行评估:
①完整的体格检查和神经系统检查。
②在NS生长图表上对生长参数进行作图。
③心电图和超声心动图对心脏功能进行评价。
④眼科检查。
⑤听力检查。
⑥包括CBC、PT/PTT的凝血功能的筛查(如果初次筛查时年龄小于12个月,12个月后需复查)。
⑦肾脏超声检查,如果尿路存在异常需进行尿液分析。
⑧对脊柱和肋骨进行临床和放射线检查。
⑨如果神经系统症状出现进行脑和颈椎MRI检查。
⑩多维度的发育方面的评估。
⑪与临床遗传医师和/或遗传咨询师进行商讨。
【治疗】
生长激素用来加速生长,部分患者能够达到接近成人的身高水平,这种治疗方法容易耐受,副作用少。密切监测出血倾向、恶性变和肥厚性心肌病。外科手术治疗先天性心脏缺陷。根据心脏状态和血液系统异常表现来限制活动。
【注意事项/预防】
如果在患者中发现了致病突变,需要对其父母进行检测以区分家系案例和散发案例。如果患者携带有胚系突变,在未来妊娠的时候可进行产前诊断。在一个家系内部Noonan综合征的表现可能差别很大。
当超声中出现囊状水瘤而羊膜细胞核型正常的时候,在缺乏家族史的情况下,需考虑进行Noonan综合征的产前检测。
父母没有Noonan综合征表现或只有部分面部表现的再发风险为5%。生殖细胞嵌合突变可能是这一风险高于普通人群的原因。受累的个体有50%的机会把这个病传给每一胎。
一旦遗传方式被确定,父母需要对每一胎的再发风险进行咨询。对于散发病例来说,受累患儿同胞的再发风险很低,例外的情况是父母存在生殖细胞嵌合体。患者的后代有50%的机会为Noonan综合征患者。
有出血倾向的患者应避免使用阿司匹林和含有阿司匹林的药物或其他能干扰凝血或血小板功能的药物。